величина, характеризующая интенсивность
реакции химической (См.
Реакции химические)
. Скоростью образования продукта
реакции называется количество этого продукта, возникающее в результате
реакции за единицу времени в единице объёма (если реакция гомогенна) или на единице площади поверхности (если реакция гетерогенна). Для исходных веществ аналогичным образом определяется скорость их расходования. Количества веществ выражают в молях (См.
Моль)
. Тогда скорости образования продуктов и расходования исходных веществ относятся как стехиометрия, коэффициенты этих веществ в уравнении
реакции. Например, в случае
реакции N
2 + ЗН
2 = 2NH
3 скорость расходования водорода в 3 раза, а скорость образования аммиака в 2 раза больше скорости расходования азота. Отношение скорости образования продукта
реакции, или скорости расходования исходного вещества, к соответствующему стехиометрическому коэффициенту называется С. х. р. В случае гомогенной
реакции, происходящей в закрытой системе постоянного объёма, С. х. р.
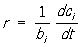
, где
ci - концентрация продукта
реакции, т. е. число молей его в единице объёма,
bi - стехиометрический коэффициент этого вещества,
t - время. Это уравнение применимо и к исходному веществу, если, как принято, стехиометрические коэффициенты исходных веществ считать отрицательными.
Для технических целей скорости гетерогенно-каталитических реакций обычно рассчитывают не на единицу поверхности катализатора, а на единицу массы катализатора или на единицу объёма слоя гранул катализатора.
С. х. р. может варьировать в чрезвычайно широких пределах - от очень малой (в случае геологического процессов, длящихся миллионы лет) до очень большой (в случае ионных реакций, завершающихся за миллионные доли секунды). О теории С. х. р. см.
Кинетика химическая. Для измерения С. х. р. служат разнообразные методы. Выбор метода определяется характером реакции и её скоростью. Не затрагивая реакций специальных типов (электродные, фотохимические, радиационно-химические), охарактеризуем основные методы измерения скоростей обычных реакций, обусловленных энергией теплового движения. При использовании статического метода реакцию проводят в замкнутом сосуде. О её скорости судят по изменению состава реагирующей смеси на основании анализа проб или по какому-либо свойству реагирующей смеси, зависящему от состава. В случае газовых реакций, сопровождаемых изменением числа молекул, часто следят за реакцией по изменению давления. Проточный метод заключается в том. что реагирующую смесь пропускают с постоянной скоростью сквозь зону реакции: для гетерогенной реакции - это обычно объём, заполненный гранулами катализатора; в случае гомогенной реакции - область повышенной температуры. Степень превращения исходных веществ в продукты определяют по составу смеси, выходящей из зоны реакции.
Оба указанных метода просты для осуществления, но не дают непосредственно значения С. х. р. В статической системе состав реагирующей смеси, а следовательно и С. х. р., изменяется во времени; поэтому требуется дифференцирование измеренной величины концентрации по времени для определения скорости реакции или интегрирование по времени теоретические выражения скорости реакции для сопоставления его с опытными данными. В случае проточного метода состав реагирующей смеси не зависит от времени, но различен в разных участках зоны реакции; поэтому сопоставление теоретического выражения для С. х. р. с результатами опыта требует предварительного интегрирования этого выражения по объёму зоны реакции.
Прямое измерение скорости гомогенной реакции достигается с помощью проточного перемешиваемого реактора. В сосуд, снабженный мощной мешалкой, с постоянной скоростью вводят исходные вещества и выводят реагирующую смесь так, чтобы её количество в реакционном сосуде было постоянно. При установившемся стационарном состоянии анализ отбираемой смеси показывает состав реагирующей смеси. Зная, кроме того, скорость отбора этой смеси, определяют количество вещества, образовавшегося в результате реакции за единицу времени, а отсюда - С. х. р. Для гетерогенно-каталитических процессов с неподвижным катализатором эквивалентом описанного метода является проточно-циркуляционный метод: однородность состава реагирующей смеси в зоне реакции достигается с помощью создаваемой насосом интенсивной циркуляции реагирующей смеси. Проточные перемешиваемые реакторы и проточно-циркуляционные системы принадлежат к классу безградиентных реакторов, называемых так потому, что в них практически отсутствуют градиенты (перепады) концентраций, а также температуры в зоне реакции.
Особые трудности возникают при изучении очень быстрых реакций в растворах. Если реакция успевает пройти в значительной степени за время, которое требуется для смешения растворов исходных веществ, то обычные методы непригодны. Задача измерения скоростей таких реакций решается с помощью релаксационных методов, разработанных М.
Эйгеном
. Система, в которой может происходить обратимая реакция, вначале находится в состоянии равновесия химического (См.
Равновесие химическое)
. Затем весьма быстро изменяют параметр, влияющий на значение константы равновесия: температуру, давление или электрическое поле. Система переходит к новому состоянию равновесия в течение некоторого времени; этот процесс называется релаксацией (См.
Релаксация)
. Следя за изменением состава каким-либо безынерционным методом (например, по электропроводности), определяют С. х. р. Удаётся наблюдать время релаксации до 10
-6 сек: таким путём была измерена, например, скорость
реакции Н
++ OH
- = H
2O в воде.
Лит.: Кондратьев В. Н., Определение констант скорости газофазных реакций, М., 1971; Колдин Е., Быстрые реакции в растворе, пер. с англ., М., 1966; Проблемы теории и практики исследований в области катализа, под ред. В. А. Ройтера, К., 1973, гл. 3; Уэйт Н., Химическая кинетика, пер. с англ., М., 1974.
М. И. Тёмкич.
